摘要:2022年7月18日,济往开来CAR-T大讲堂第三期线上讨论会召开,主题为《血液肿瘤的细胞免疫治疗新进展》。会议开始,来自北京高博博仁医院的潘静主任跟大家讲述了她眼中的急性白血病的CAR-T治疗进展。免疫治疗蓬勃发展,CAR-T治疗大显身手免疫治疗被认为是癌症治疗的突破性疗法,目前已与传统化疗、放疗、手术和靶向治疗并列,成为癌症治疗的五大支柱。CAR-T细胞治疗是免疫治疗的一种,全称是嵌合抗原受体
2022年7月18日,济往开来CAR-T大讲堂第三期线上讨论会召开,主题为《血液肿瘤的细胞免疫治疗新进展》。会议开始,来自北京高博博仁医院的潘静主任跟大家讲述了她眼中的急性白血病的CAR-T治疗进展。

免疫治疗被认为是癌症治疗的突破性疗法,目前已与传统化疗、放疗、手术和靶向治疗并列,成为癌症治疗的五大支柱。CAR-T细胞治疗是免疫治疗的一种,全称是嵌合抗原受体T细胞治疗,主要通过激活人体自身免疫系统达到识别和攻击肿瘤细胞、治疗疾病的目的。作为一种新型治疗手段,CAR-T疗法为传统治疗后复发或难治的患者带来了新的希望,并且极具潜力在肿瘤治疗中发挥更大的作用。
CAR-T细胞疗法在血液恶性肿瘤的治疗中效果显著,早在2017年就有CAR-T细胞疗法获批用于急性淋巴细胞白血病的治疗,随后多种CAR-T细胞疗法陆续获批。到目前为止,距离CAR-T细胞疗法开始应用已经过去了5年,不断发展的同时,CAR-T疗法也在面临各种各样的挑战。
讨论会中,潘静教授主要就急性B系淋巴细胞白血病、急性T系淋巴细胞白血病和急性髓系白血病的CAR-T治疗进展分别进行介绍。
2022年EHA大会已于6月成功召开,会上发布的一项最新长期数据表明,对于儿童和25岁以下的复发难治性急性B系淋巴细胞白血病年轻患者,CAR-T疗效显著。中位无病生存期(RFS)长达43个月,并且只有四分之一的患者后续接受了移植,大部分患者没有接受移植。潘静主任表示:“CD-19 CAR-T对于这类患者基本可以达到治愈水平,这些数据非常令人惊喜。”
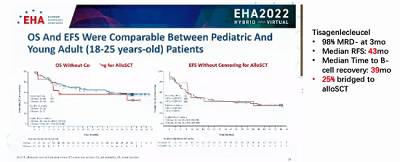
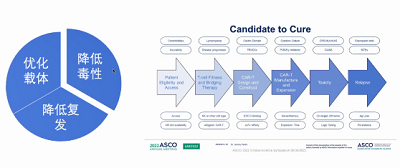
CAR-T治疗在急性B系淋巴细胞白血病中的进展主要体现在以下3个方面:
(1)降低毒性,包括远期毒性和长期毒性;
(2)优化载体;
(3)降低复发。
前期各项研究多数专注于如何防止复发或延长生存期,随着CAR-T疗法应用的人群越来越广,需要加强关注长期毒性问题。上述研究显示,B细胞恢复的中位时间大概为39个月,因此患者长期处于B细胞缺陷状态。考虑到感染的可能性,目前几乎所有的患者(80%)在接受CAR-T治疗后都要输注丙种球蛋白(IVIG),而且时间很长,患者每个月为此花费几千元,也增加了经济负担。
着眼未来,不仅疗效要进一步提高、靶点要进一步精准,而且要把不良事件往下降,精准处理每一个可能会影响预后的问题,从而帮助患者脱离长期副反应。

在复发/难治B细胞肿瘤的治疗中,CAR-T细胞治疗取得了前所未有的成功;但对于T细胞肿瘤的治疗,目前开展的CAR-T临床试验多数靶点处于临床前阶段,且临床试验数量远少于B细胞肿瘤。值得注意的是,美国、欧洲等地区今年陆续在开展CD7的相关临床研究。
潘静主任在讨论会中分享了其团队供体来源的CD7 CAR-T细胞治疗T细胞急性淋巴细胞白血病的I期试验的疗效和安全性的最新进展,该研究也作为血液恶性肿瘤相关的中国研究之一入选2022 ASCO年会。
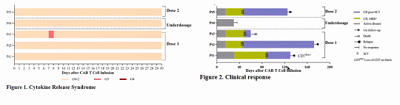
截至2022年02月14日,20例入组患者中19例(95%)有应答,中位随访时间为15.8个月(范围13-18.3),输注后第30天的客观缓解率和完全缓解率分别为95%和85%。
1年无进展生存率(PFS)和总生存率(OS)分别为51.6%(95%CI,24.7-78.4%)和72.5%(95%CI,51.9-93.0%)。
在随访的19例应答者中,2例 (11%) 分别在第55天和第271天退出其他治疗;
在未接受进一步治疗的10例 (53%) 患者中,直至末次访视,所有患者均持续可检测到 CAR T 细胞,3例仍处于缓解状态,3例复发(1例CD7 + 和2例CD7-),4例死于感染;7例 (37%) 患者继续接受SCT,SCT后未检测到 CAR T 细胞,其中2例仍处于缓解期,4例复发(3例CD7 +,1例CD7-),1例死于移植相关死亡。
(1)短期不良事件包括3级或以上的细胞因子释放综合征 (10%) 和1-2级的移植物抗宿主病 (GVHD,60%),均可逆。
(2)5例缓解者发生了6起迟发型(输注后>30天)重度不良事件 (SAE);
(3)新观察到4例SAE,包括1例患者在第11个月时发生的4级肠道 GVHD 和1例患者在第12.3个月时发生的5级肺炎,1例患者在第8.7个月时发生的5级铜绿假单胞菌肺炎,以及1例患者在第11个月时发生的3级巨细胞病毒 (CMV)脑炎,另1例患者在第13.3个月时恢复。
(4)所有重度感染均发生在未接受进一步治疗的患者中,其中总 T 细胞达到中位计数300.03/μL(范围121.46-512.83),尽管稳步升高,但显著低于正常水平。
供体来源的 CD7 CAR T 细胞疗法在治疗复发/难治性T淋巴细胞白血病(r/r T-ALL) 方面显示出令人鼓舞的活性。
复发是阻碍长期结果的主要问题。在 CAR T 细胞监测下,通常观察到 CD7 阴性复发。此外,有可能发生迟发型 GVHD 和感染,应谨慎处理。
此外,潘静教授还指出了T系急淋的CAR-T治疗未来需要解决的问题,短期问题的关键在于如何缓解、制备细胞的来源及安全性,而长期问题的关键在于到底要不要进行巩固治疗、复发机制研究以及长期不良反应。
目前CAR-T疗法的主要临床策略有3类类型,分别为自体、移植相关供者、无关供者(通用型)。自体CAR-T疗法的优点是无排异反应,缺点是需要抓住采集窗口期、CART活性和质量不一、T-ALL患者容易被肿瘤污染;移植相关供者的优点是容易植入、方便动员、不受患者自身条件限制,缺点是容易出现GVHD、未接受移植的患者仅T-ALL适用、部分需要桥接移植;无关供者的优点是CART制备和储存方便、可用于无法获取自体T细胞的患者,缺点是容易出现GVHD、体内扩增及存活时间有限。
临床策略的改进应侧重于使用供者或通用型CAR,避免肿瘤污染。

针对急性髓系白血病,目前的免疫治疗进展较慢,而且临床试验较少,主导方案依然是靶向药物治疗或者去甲基化药物联合靶向药物治疗。
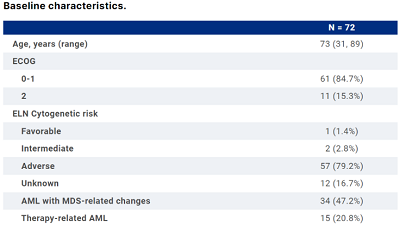
潘静主任表示,将来急性髓系白血病的免疫治疗突破点可能在于CD 47抗体,2022 ASCO年会期间,吉利德公布了抗CD47单抗magrolimab联合阿扎胞苷一线治疗TP53m AML患者的耐受性和疗效1b期试验数据,研究共纳入72例TP53突变AML患者(如下表)。研究结果显示,客观缓解率(ORR)为48.6%,16.7%患者疾病稳定,5.6%患者疾病进展(PD)。总而言之,在不适合强化化疗的TP53突变的AML患者的一线治疗中,Magrolimab联合阿扎胞苷显示出良好的疗效。
总而言之,B系淋巴细胞白血病的CAR-T 治疗目前已经逐渐进入精准治疗阶段;T系淋巴细胞白血病的CAR-T治疗步入多中心验证阶段,CD7有希望取得新的进展,但整个治疗体系和机制研究尚未开始;急性髓系白血病的免疫治疗目前主要是抗体和靶向药的联合使用。
CAR-T细胞疗法在急性白血病中的应用值得关注和期待,相信未来将会有越来越多患者因此获益。
2025-12-22 23:27:23
2025-12-21 23:48:54
2025-12-21 23:25:29
2025-12-16 21:14:26
2025-10-27 20:27:48
2025-10-27 20:22:03
2025-10-27 20:09:53
2025-10-27 20:06:57
2025-10-27 14:39:47
2025-10-27 14:36:11